
2025年9月11日,马来西亚医疗器械管理局(MDA)发布《2025年医疗器械(修正)条例》[P.U. (A) 330],宣布对A类医疗器械的注册费用进行重要调整。此次费用调整将直接影响所有计划进入马来西亚的A类产品(低风险等级,如医用口罩、基础体温计、非活性敷料等)企业的准入成本。
-新旧费用对比
|
|
注册申请费 | 注册费 |
|
旧标准(2025年及以前) |
RM 100 |
RM 500 |
|
2026年新标准 |
免费 | RM 750 |
-生效日期
1. 2025年12月10日前提交注册并完成付款,视为2025年度申请,将按现行流程和费用处理。
2. 2025年12月10日之后至年底期间收到的申请,MDA将自2026年1月起审核,并自动适用新的费用标准(即共计1250令吉)。
3. 新费率适用于在2026年1月1日及之后提交的所有新注册和再注册申请。
-丽和康建议
1.提前规划好产品注册计划,虽然单个产品注册准入成本增幅仅RM 1150(约2000人民币),但累计超过10个以上产品,也是一笔不小的费用(足矣用于东南亚其他国家注册)。
2.把握好时间节点。首先是注册递交的时间,2025年12月10日提交的申请,到2026年1月起审核,中间也会因为政策过渡有将近20天左右的官方时间延迟;第二是费用节点,如果确实要赶前一波费用红利,从现在开始就着手准备,一方面选专业的服务CRO公司需要时间,另一方面确定好服务商后,双方付款流程、以及服务商处理递交文件注册到完成付款也需要时间,按丽和康过往项目经验,至少需要预留5-7个工作日左右的时间处理双方公务方面的时间,最后,A类产品资料并不复杂,但是如果一开始并没有准备过全套的英文资料,还需要预留翻译、资料确认的时间。因此,如果确定要做马来西亚,从10月现阶段开始准备,选择好专业的注册CRO公司,预计能顺利赶上这波马来西亚A类单个准入RM 100的末班车!
-丽和康东南亚服务简介
🌏 医疗器械和IVD · 马来西亚一站式注册服务
丽和康国际 助您快速合规进入 东盟市场!
✅ 全流程解决方案:
📌 注册申报:专业团队对接MDA,覆盖A/B/C/D类器械及IVD
📌 体系合规:ISO 13485/GMP/MDSAP辅导,确保符合EPSP安全原则
🔥 自有物流:吉隆坡保税仓+冷链运输,缩短清关时间50%!🚗
📩 立即咨询:
联系人: 丽和康小助手 15361517196

丨内容策划:丽和康国际&市场部
【声明】本文部分内容和图片整理自马来西亚官网,不代表丽和康观点。 如有侵权请联系删除,我们将及时处理以保障双方权益。
近年来,随着集采政策的深入推进及国内医疗器械市场竞争的白热化,产品出海已逐渐成为行业突破增长瓶颈的关键路径。
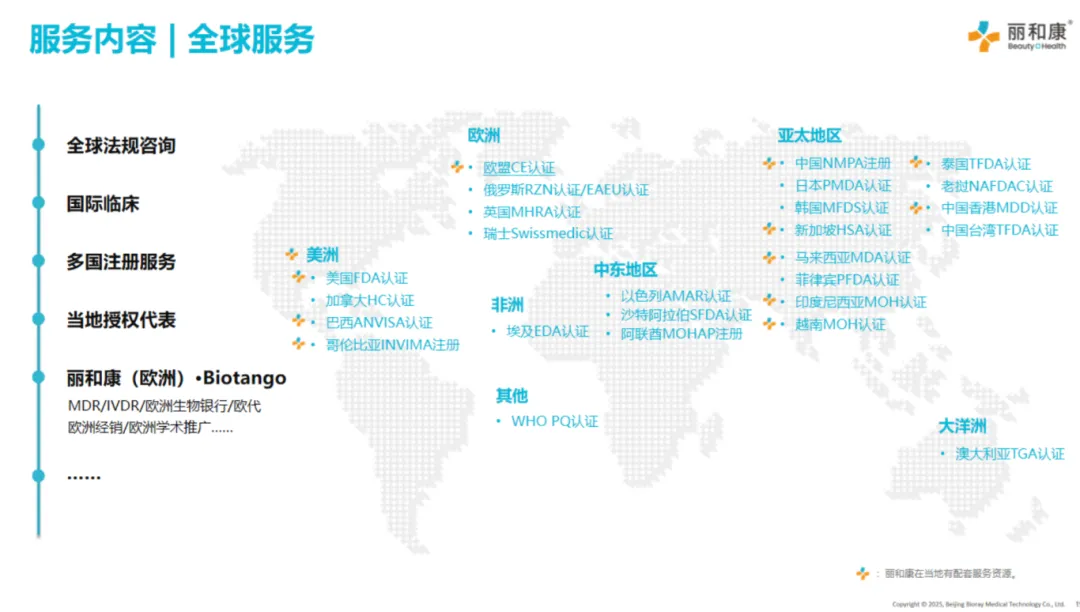
丽和康已在中国香港、欧洲(波兰)、美国(明尼苏达)、东南亚(新加坡、越南等)设立分公司/办事处,拥有精通全球法规、海外注册及出口经销的资深行业专家团队,可以为为全球医疗器械(含IVD)企业提供:合规准入规划、注册认证、临床研究、当地授权代表(如适用)、市场推广及经销服务(欧洲)等一站式服务。
如果您有产品计划出口欧美、东南亚、中东、中亚等国家或地区,可以扫码添加上方丽和康小助手,获取更多定制化优质服务!
【推荐阅读】