2024年3月19日,国家药监局器审中心组织制定的《医疗器械可用性工程注册审查指导原则》及相关应用说明正式发布,并要求自同年10月8日起相应医疗器械产品注册时需提交可用性测试资料,而手术导航定位系统(带机械臂及末端执行器)、输液泵、呼吸机等高风险产品亦在列。
除了满足多国准入注册要求外,合理有效的可用性测试能预防用户误操作,降低风险,保障患者安全,提升产品合规性、安全性和市场竞争力,并可有效助力企业降本增效,加速上市,为产品迭代和创新提供依据。
综上考虑,广东省食品药品审评认证技术协会联合广州海关技术中心、北京宝丽永昌医药科技有限公司、广东医谷计划于2025年4月9日开展“医疗器械EMC测试要点及可用性实践应用探讨”专题沙龙,深度探讨医疗器械电气安全性及可用性法规要求差异、理论基础和实践应用。
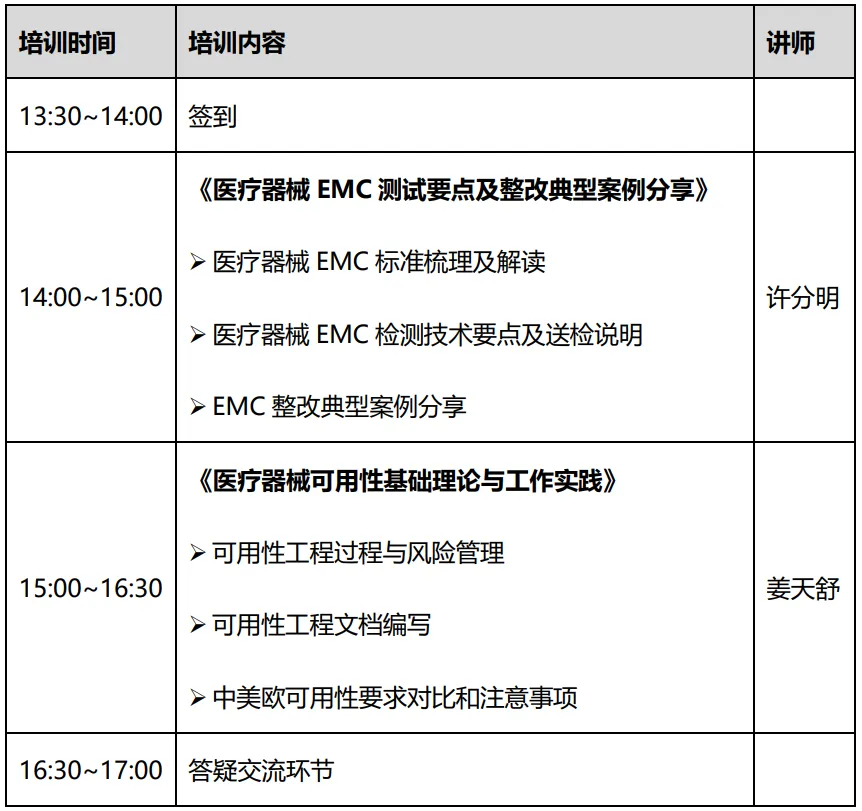
活动时间:
2025年4月9日 下午1:30-5:00
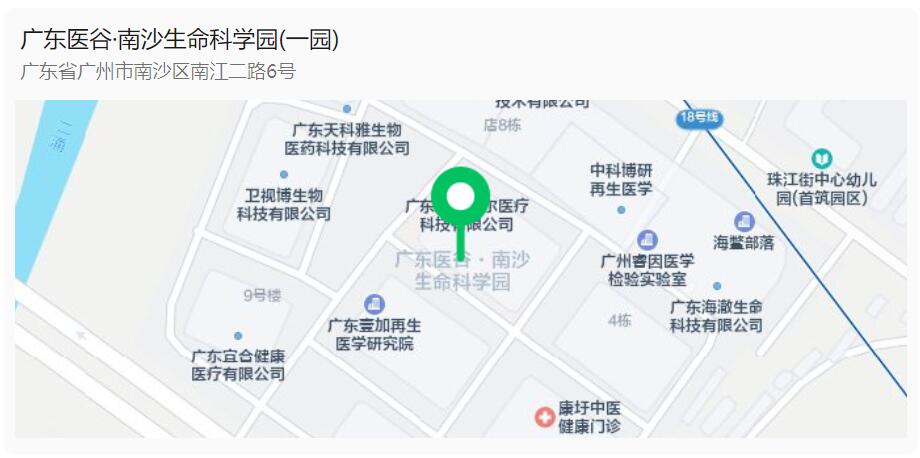
活动地点:
广东医谷(广州市南沙区南江二路6号)·1栋多功能厅
主办单位:广东省食品药品审评认证技术协会
支持单位:广州海关技术中心(IQTC)、北京宝丽永昌医药科技有限公司、广东医谷
开展委托生产、受托生产企业的相关人员:最高领导者、管理者代表、质量管理人员、各部门负责人、医疗器械生产及研发人员、其他有学习需求的人员。
· 长期从事医疗器械、电子电气产品电磁兼容技术研究与进出口检验检测方面工作;
· 熟悉医疗器械、电子电气产品EMC国内外相关监管要求,熟悉相关产品国际标准、国标及行标检验检测标准要求,具有丰富的EMC检验检测实践经验。
· 旅美7年,原明尼苏达大学生物医学工程研究员;
· 生物医学工程、机器人工程双硕士学位,有深厚的医工背景;
· 主导完成多个医工与可用性结合研发项目,具有丰富的产研及可用性工程项目实施经验。
扫描下方二维码报名

