据美国医疗旅游协会报道,全球医疗旅游产业市场规模预计以每年15%-25%快速增长。Insights10 预测,到2030年,巴西医疗保健市场预计将达到 130亿美元。

图片源自网络,侵删
巴西到底有何种优势吸引来自北美、欧洲甚至其他拉美国家的游客医旅消费,实现逆袭增长?中国医疗器械企业又有哪些契机?进入巴西市场需要了解哪些内容做到事半功倍……
丽和康小课堂带您逐一揭秘!文末还有独家福利,篇幅较长,建议先收藏继续看~
01
巴西基本国情概述
巴西联邦共和国(葡萄牙语:República Federativa do Brasil;英语:The Federative Republic of Brazil),简称巴西(Brazil),位于南美洲东部,东濒大西洋,是拉美地区最大的国家,首都为巴西利亚,官方语言为葡萄牙语,国土总面积851.04万平方公里,全国共分26个州和1个联邦区。
图片源自网络,侵删
2023年人口约2.2亿(同比2022年上涨0.51%,属于人口增长型国家),人均GDP约10043.6美元(中国:人均GDP约12700美元),根据世界银行标准划分,属于中高等收入国家。巴西拥有丰富的自然资源和人力资源,农牧业发达,工业基础较为完整,服务业较为发达,经济发展潜力较大。
巴西的卫生服务网络由两大子系统构成:“统一医疗体系”政府举办的医疗机构;私立医院、诊所等补充医疗系统。社保/医保方面则实行全民免费医疗制度、私人健康保险制度双结合。
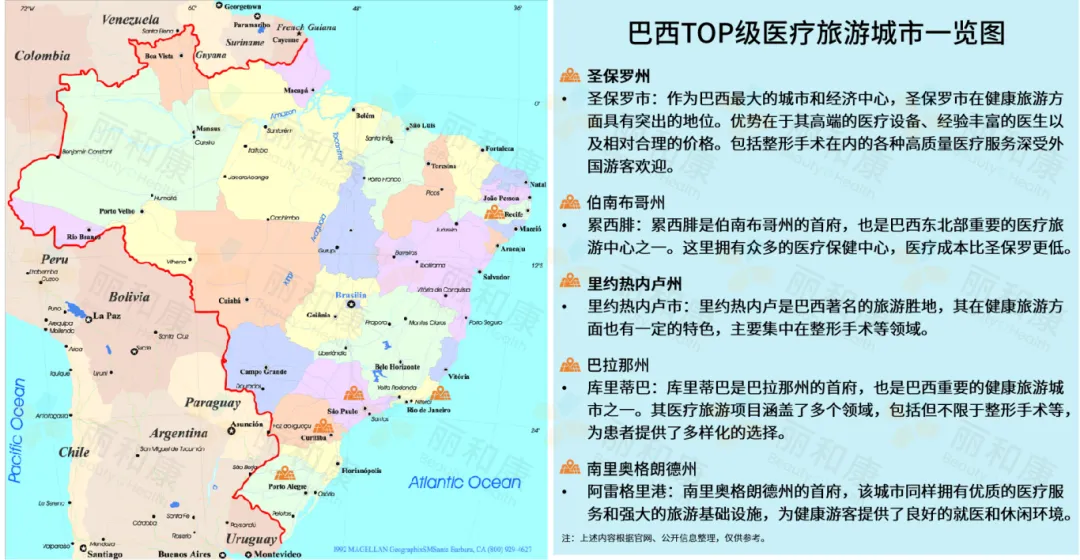
据悉,巴西目前已有超50多家医院获得国际医疗卫生机构认证联合委员会 (JCI) 认证,这些医院具有较高的国际认可度,同时JCI认证的医院可够获得国际医疗保险赔付,为外国患者提供了国际医疗保险保障。
02
巴西有哪些商机?
中国连续多年为巴西最大贸易伙伴、第一大出口目的市场和第一大进口来源国。2024年,中巴建交50周年,同年11月,中巴两国签署《共建“一带一路”倡议》等系列合作计划。
中巴关系现处于呈现“政经双热”的特点,这种良好的双边关系为中国企业进入巴西市场奠定了坚实的贸易基础。对国内医疗器械企业而言,具体有哪些机会呢?

图片源自网络,侵删
医疗器械产品方面:根据国际美容整形外科学会(ISAPS)的数据,巴西是世界上进行美容整形手术数量第二多的国家,仅次于美国。此外,包括减肥手术、牙科和骨科等领域都受到追捧。这些领域的企业可以多留意相关需求。
IVD产品方面:由于巴西地处热带,热带病(如登革热、疟疾)高发,加之本土检测技术薄弱,感染性疾病诊断产品需求量大。此外,受人口老龄化和慢性病高发的推动,糖尿病管理、肿瘤标志物筛查和遗传病诊断也有着较好的应用场景。
尽管市场前景广阔,进入巴西仍需克服复杂的医疗法规、严格的进口产品认证要求等壁垒。此外,本土化要求、文化差异、产品经销等同样也是中国企业需要提前布局的重要课题。
03
巴西医疗器械监管机构简介
巴西卫生监管局(Agência Nacional de Vigilância Sanitária,简称 ANVISA)是巴西卫生部下属的行政机构,也是巴西国家卫生系统 (SUS) 的组成部分,负责协调巴西卫生监管系统 (SNVS),并在全国各地设有办事处。
该机构监管范围涵盖医疗器械、体外诊断产品以及药品、卫生用品、化妆品等健康相关产品,负责这些产品的上市前审批与上市后监督。其在巴西的卫生监管体系中的角色和地位,类似于美国的 FDA 和中国的 NMPA。

2024年12月2日,Anvisa 推出了新的立法门户网站 Anvisalegis,该门户网站汇集了 Anvisa 当局的一整套监管标准和监管过程中的所有其他出版物,如公告、公众咨询、指南、监管影响分析报告等。如您有需要,可以点击下方网站进行信息检索。
Anvisalegis网址: https://anvisalegis.datalegis.net/
04
产品风险等级分类、注册路径
ANVISA将医疗器械及体外诊断试剂(IVD)产品风险等级分为4级:Ⅰ、Ⅱ、Ⅲ、Ⅳ;Ⅰ类风险最低,Ⅳ类风险最高。
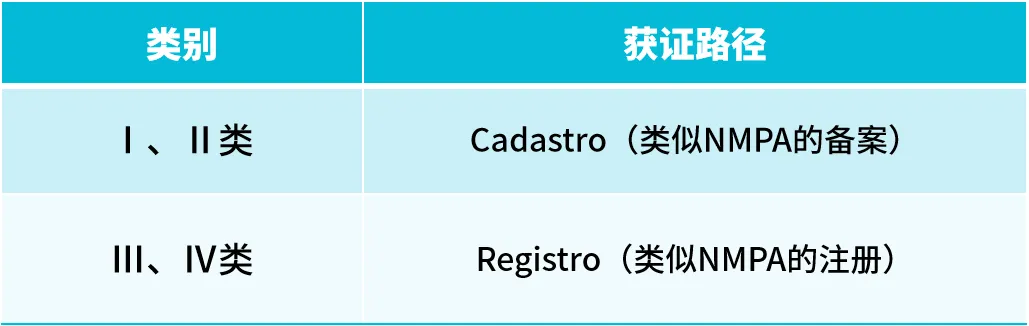
丽和康整理了ANVISA有关医疗器械及体外诊断试剂(IVD)产品风险等级分类规则、注册(监管)路径的相关内容,供您参考学习。

扫码添加小助手,可获取原图
您也可以通过下方ANVISA官方链接进行产品分类查询,如有需要可联系丽和康工作人员进一步咨询。
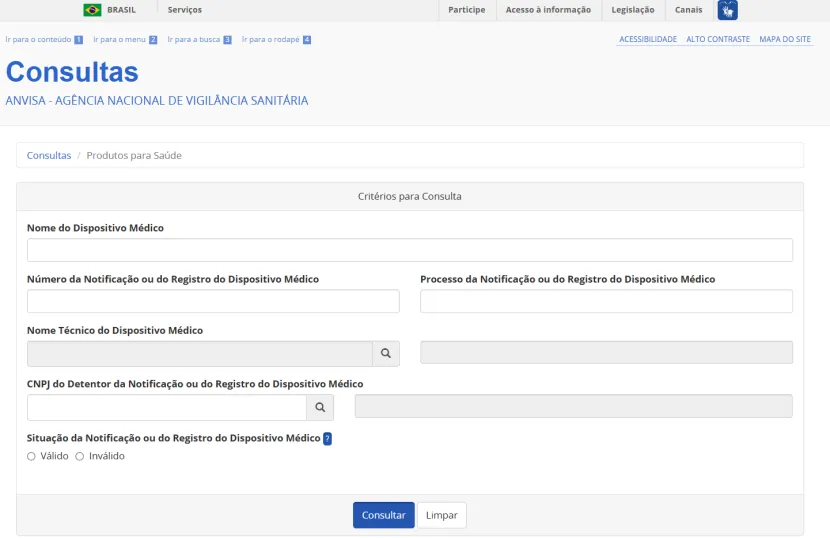
ANVISA官方查询网址:
https://consultas.anvisa.gov.br/#/saude/
05
注册官费、周期及证书有效期
1.官方费用:注册官费、BGMP审核费用会根据公司规模大小、产品风险等级有差异。注册审核费用参考范围——低风险200~300美金,高风险1000~4000美金;BGMP审核费用约为20000美金左右。具体以官方最终报价为准。

2.产品证书有效期:Ⅰ、Ⅱ类证书永久有效;Ⅲ、Ⅳ类证书为10年有效期,需提前6个月申请更新认证。
3.注册周期:一般来说,在所有必备的资料(如检测认证资料、临床资料、体系等)都齐全的情况下,Ⅰ、Ⅱ类6-10个月,Ⅲ、Ⅳ类1.5-2年。此外如果需BGMP审核,还需至少多预留1年的时间。
06
其他相关要求
1.体系相关:Ⅰ、Ⅱ类产品不需要进行BGMP现场审核,仍需要按BGMP要求建立体系;Ⅲ、Ⅳ产品,需要进行BGMP现场审核,并且要在申请注册前需要获得ANVISA颁发的BGMP证书。
BGMP每2年审核一次,如已获得MDSAP证书,审核周期延长为4年,需要提前6-9个月提交申请进行更新,并再次支付审核费用。另外,申请BGMP也需要由巴西授权代表(BRH)提出。
2.INMETRO认证:有源医疗器械及部分无源器械(如:皮下针、乳房植入物、手术/检查手套、注射器等)需要获得该认证,该证书永久有效,但需要定期认证维护。
3.ANATEL认证:具有射频(RF)、蓝牙、WiFi等通讯功能的产品需要完成ANATEL认证,证书有效期2-5年,需要定期认证维护。
4.FSC证书:I类和II类没有强制要求。
5.UDI要求:有专门的UDI数据库(RDC 591/2021——UDI指南文件)。
6.注册资料递交:由巴西授权代表(BRH)通过ANVISA的电子系统递交。
7.语言要求:标签和说明书必须用葡萄牙语,其他文件可以用葡萄牙、西班牙语或英语。
07
巴西注册工作概览
丽和康团队依据过往项目经验总结了相关巴西注册的主要工作流程,供您参考学习。

08
有关巴西授权代表(BRH)职责
Brazil Registration Holder (BRH),通常称为巴西授权代表或巴西注册信息持有人,是巴西境外制造商与当局的联络人,负责制造商在巴西医疗器械的注册登记和上市后监管的相关事宜,其主要职责至少应包括下图内容。

巴西市场前景虽好,但从产品获证到出口销售,并非易事。为此,丽和康小课堂整理了医疗器械(含IVD)巴西注册、贸易投资必看的资料包,以便您进一步了解产品出口巴西相关事宜,转发本篇推文至朋友圈(全员可见)+添加小助手即可免费获取。

如您有产品计划出口巴西,敬请垂询小助手或丽和康工作人员,丽和康团队可以为您提供包括但不限于以下服务:
✓ 产品分类界定
✓ ANVISA认证
✓ BGMP/MDSAP体系认证辅导服务
✓ 可用性测试服务
✓ 巴西授权代表(BRH)
✓ 国际临床试验
……