2025年4月1日,北京亦庄锋创科技园内,一场专为医疗器械企业量身打造的出海专题活动圆满落幕。本次活动由锋创科技园携手丽和康、E药经理人联合举办医疗器械全球上市流程培训活动,旨在助力医疗器械企业全面剖析全球市场,掌握上市流程,轻松出海,走向国际。
活动中,专家讲师刘家岐(丽和康——产品认证部总监)深入剖析全球医疗器械市场大环境。从行业趋势到机遇洞察,从美国FDA、欧洲CE市场准入规则到东盟国家注册流程,凭借其丰富的行业经验,为参会者解锁了法规要求背后的关键密码,让企业对出海之路有了清晰的认知。

——丽和康•产品认证部总监 刘家岐 作《医疗器械全球上市流程》演讲
根据MedWorld数据,2024年美国和欧盟依然是我国医疗器械出口的主要目的地。

注: 信息引自MedWorld器械世界
以下内容精选了部分FDA及CE认证的关键知识点:
美国FDA• 产品分类规则:
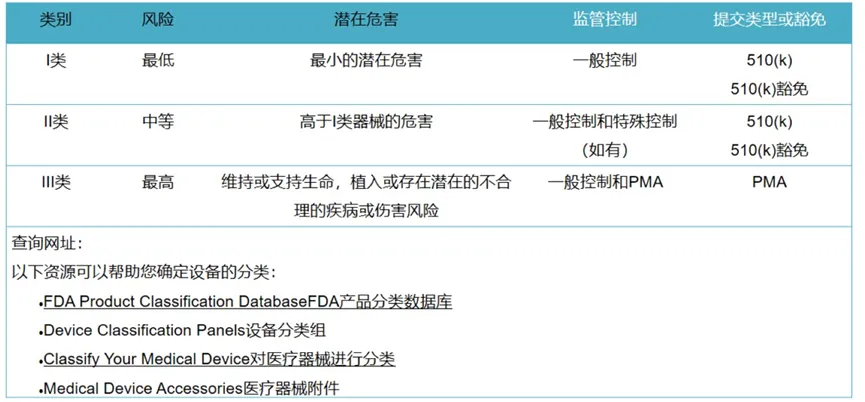
• 产品上市路径

• 注册流程

• 注册资料要求

(图片为资料要求部分截取,完整版申报指南请私信小客服获取~)
• 产品分类规则:
考虑医疗器械设计及制造对人体可能带来的危险程度,可将医疗器械分为以下4类:
Class I 低风险 (Low risk) ---Is/Im/Ir
Class IIa 低到中风险 (Low to medium risk)
Class IIb 中风险 (Medium risk)
Class III 高风险 (High risk)

• 注册流程

• 技术资料要求

未来,丽和康将继续深入园区,结合企业需求举办更多活动,为企业搭建更广阔的国际交流平台,助力更多医疗器械企业走向国际市场,实现全球布局。
 注意,干货来啦!
注意,干货来啦!
没有参加本次线下培训的伙伴
可以添加微信(备注公司姓名)
领取电子课件
如您有产品计划出口海外,敬请垂询小助手或丽和康工作人员,丽和康团队可以为您提供包括但不限于以下服务:
✓ 产品分类界定
✓ ANVISA认证
✓ BGMP/MDSAP体系认证辅导服务
✓ 可用性测试服务
✓ 国际临床试验
……