为了规范医疗器械注册人/备案人对受托生产企业的管理,结合医疗器械相关法规政策的要求、长三角区域行业对于医疗器械委托生产相关要求制定团体标准《长三角区域医疗器械委托生产质量管理指南》T/SDMDA 003-2024 于2024-05-27发布,2024-06-01 实施,以下简称《指南》。
长三角地区是最早推行医疗器械产品注册人制度的试验区,此份《指南》出台近一步加速和指导医疗器械注册人制度在长三角区域的实施工作,尤其集团内委托生产的情形,一方面替注册申请人解决资金资源重复投入的问题,另一方面帮助注册申请人落地指导监管受托方,很大程度上规避了质量管理体系合规的风险,从而加速医疗器械产品上市。
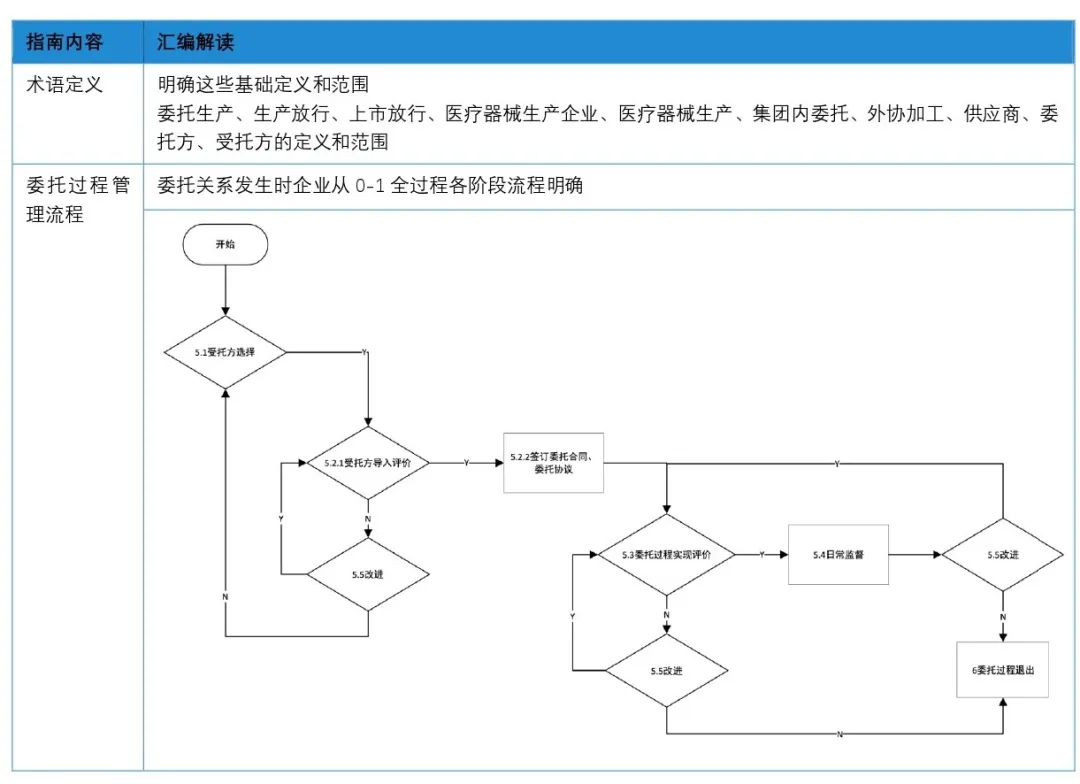
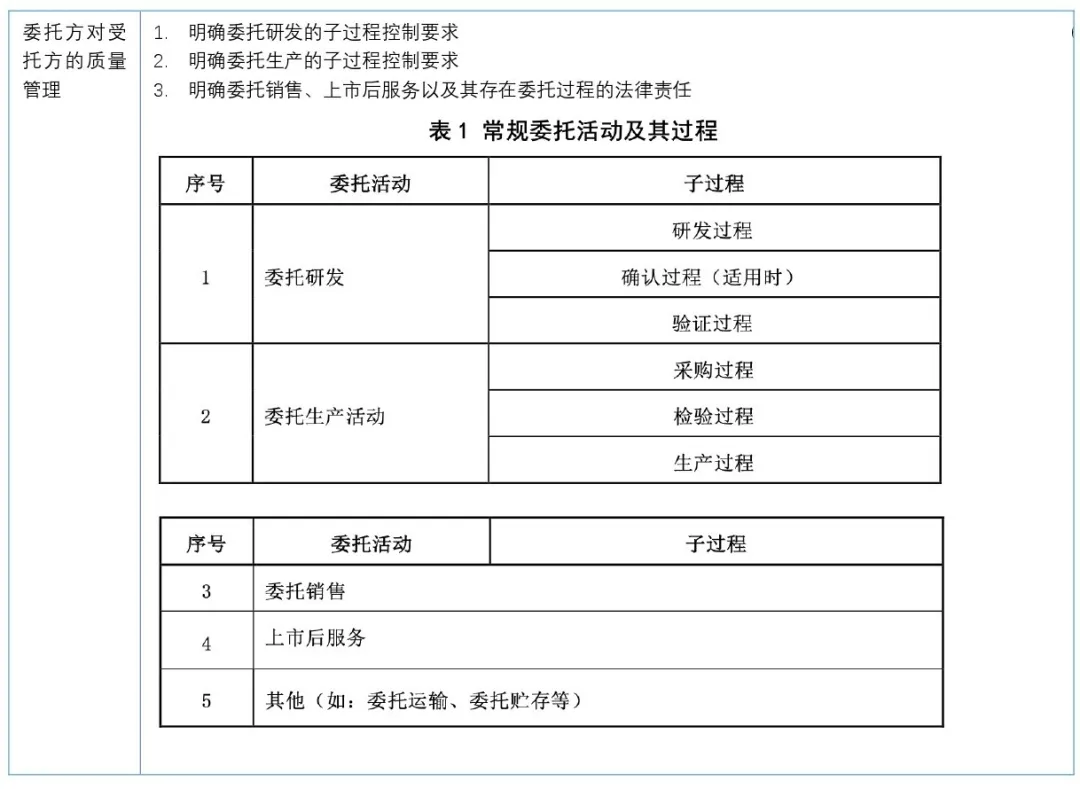
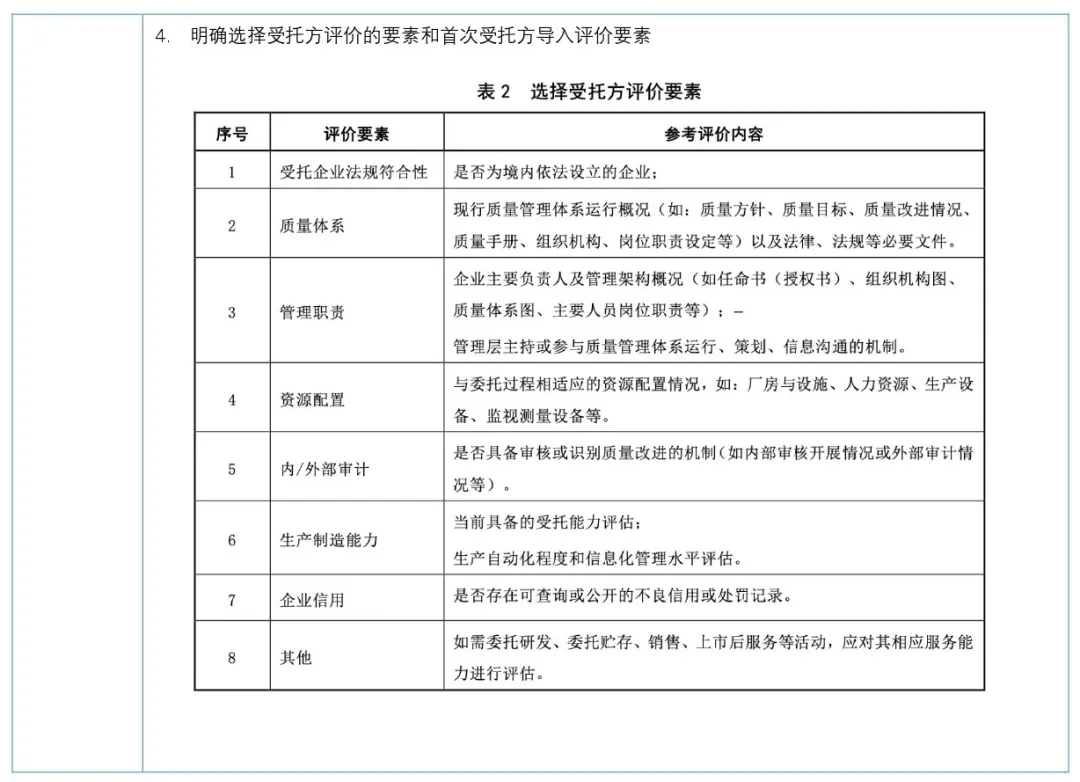
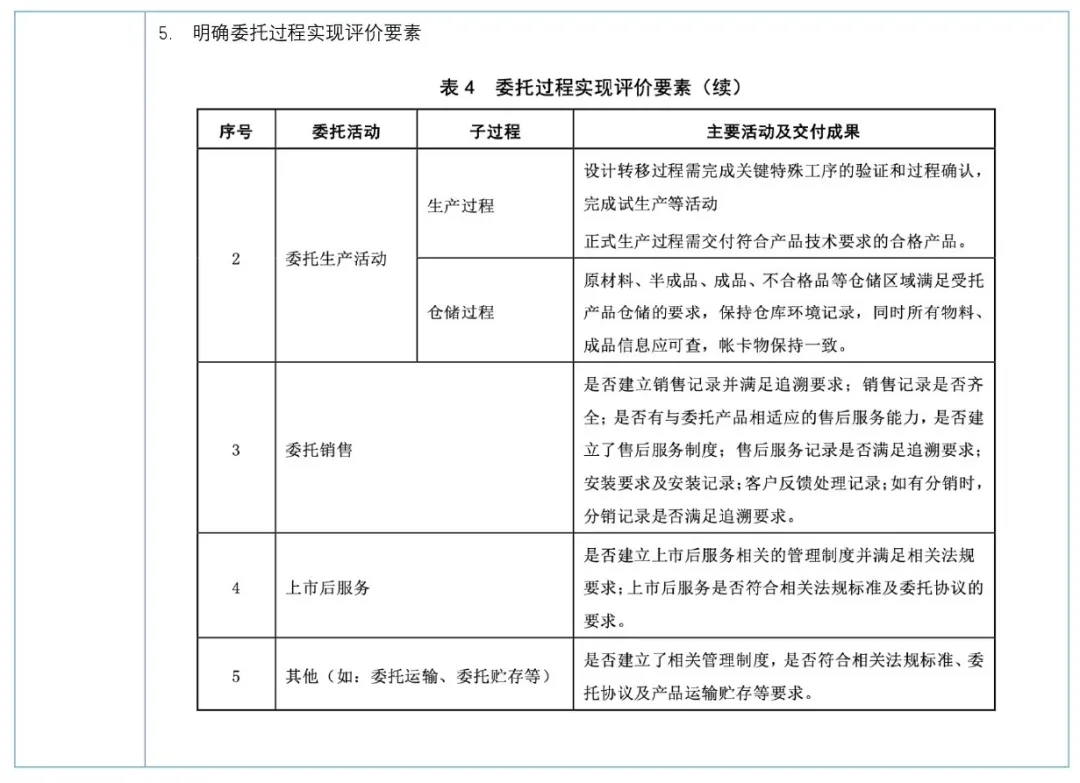





《指南》于2024年06月1日开始正式实施,建议注册申请人从以下几个方面做好委托方和受托方质量管理体系自查和整改工作;
1. 注册人委托研发的情形
识别委托研发活动确认委托研发活动的子过程具备完整性,委托研发各子过程研究记录的可追溯性,例如工艺配方研究过程、关键性能参数验证、形成、移交是否能满足配套法律法规的要求。2. 注册人委托生产的情形
识别委托生产的活动,尤其采购过程、检验过程、生产过程、仓储管理、原材料验收验证等,委托方受托方双方是否形成相关质量协议、文件交付移交标准清单、所有活动过程记录保持和可追溯性,需要双方共同决策的部分是否符合要求。
3. 受托方选择评价情况
依据《指南》5.1受托方选择评价条款,对现有已完成评价的受托方评估其符合性。
4. 首次入选受托方评价
依据从2024年6月1日开始《指南》5.2条要求执行。
近年来在医疗器械注册人制度背景红利下,委托生产已然成为当前大部分医疗器械产品准入行业的首要选择路径之一,该制度在推行以来为了有效防控医疗器械全生命周期的质量安全风险,国家局以及当地监管部门陆续出台一系列监管制度,其目的全面落实医疗器械注册人质量安全主体责任;加强对受委托生产企业的监管和责任。
更多关于医疗器械委托生产情形的质量管理体系评估工作,需结合具体的产品以及注册申请人实际质量管理体系运行现状详细评估,欢迎联系丽和康小客服,获取免费评估咨询。